Boudouard reaksiyonu
Adını Octave Leopold Boudouard'dan alan Boudouard reaksiyonu, belirli bir sıcaklıkta karbon monoksit ve karbon dioksitin kimyasal denge karışımının redoks reaksiyonudur. Karbon monoksitin karbondioksit ve grafite orantısız hale gelmesi veya bunun tersidir:[1]
- 2CO Şablon:Eqm Şablon:Chem + C
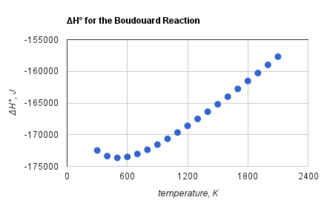
Boudouard reaksiyonunun karbondioksit ve karbon oluşturması tüm sıcaklıklarda ekzotermiktir. Ancak Boudouard reaksiyonunun standart entalpisi, yanda gösterildiği gibi[2] artan sıcaklıkla daha az negatif hale gelir.
Şablon:Chem oluşum entalpisinin Şablon:Chem 'dan daha yüksek olduğu durumda, oluşum entropisi çok daha düşüktür. Sonuç olarak, Şablon:Chem oluşumunun standart serbest enerjisi neredeyse sabittir ve sıcaklıktan bağımsızdır; Şablon:Chem oluşumunun serbest enerjisi ise sıcaklıkla birlikte azalır.[3] Yüksek sıcaklıklarda ileri reaksiyon endergonik hale gelir ve ileri reaksiyon hala ekzotermik olmasına rağmen CO'ya doğru (ekzergonik) ters reaksiyonu tercih eder.
Sıcaklığın Boudouard reaksiyonunun boyutu üzerindeki etkisi , reaksiyonun standart serbest enerjisinden ziyade denge sabitinin değeri ile daha iyi gösterilir. Kelvin cinsinden sıcaklığın bir fonksiyonu olarak reaksiyonun log10(Keq) değeri (500-2200 K arasında geçerlidir) yaklaşık olarak şöyledir:[4]
Şablon:Matematik değeri Şablon:Val'da sıfırdır.
Keq sıcaklıkla değişimin anlamı, Şablon:Chem içeren bir gazın, karışımın belirli bir sıcaklığın altına soğuması durumunda elementel karbon oluşturabileceğidir. Karbonun termodinamik aktivitesi bir Şablon:Chem/Şablon:Chem karışımı için her türün kısmi basıncı ve Keq değeri bilinerek hesaplanabilir. Örneğin, yüksek fırında demir oksidin indirgenmesi veya karbürleme atmosferlerinin hazırlanması için oluşturulan ortam gibi yüksek sıcaklık düşürücü bir ortamda,[5] karbon monoksit, karbonun kararlı oksitidir. Şablon:Chem bakımından zengin bir gaz, karbon aktivitesinin 1'i aştığı noktaya kadar soğutulduğunda Boudouard reaksiyonu gerçekleşebilir. Karbon monoksit daha sonra orantısız olarak karbon dioksit ve grafite dönüşerek kurum oluşturur.
Endüstriyel katalizde bu sadece göze batan bir durum değildir; kurumlama (aynı zamanda koklaşma olarak da adlandırılır), katalizörlerde ve katalizör yataklarında ciddi ve hatta geri dönüşü olmayan hasara neden olabilir. Bu, petrolün katalitik reformasyonunda ve doğal gazın buhar reformasyonunda bir sorundur.
Reaksiyon, adını 1905 yılında bu dengeyi araştıran Fransız kimyager Octave Leopold Boudouard'dan (1872–1923) almıştır.[6]
Kullanım Alanları
Karbon monoksitin katalizörler üzerindeki zararlı etkisi arzu edilmese de, bu reaksiyon karbon nanotüplerinin üretilmesinin yanı sıra grafit pulları, filamentli grafit ve katmanlı grafit kristalitlerinin üretilmesinde de kullanılmıştır.[7][8][9][10] Grafit üretiminde kullanılan katalizörler molibden, magnezyum, nikel, demir ve kobalttır,[7][8] karbon nanotüp üretiminde ise molibden, nikel, kobalt, demir ve Ni-MgO katalizörleri kullanılır.[9][10]
Boudouard reaksiyonu yüksek fırın içindeki önemli bir süreçtir. Demir oksitlerin indirgenmesi, katılar arasındaki reaksiyonlar genellikle çok yavaş olduğundan doğrudan karbonla değil, karbon monoksitle sağlanır. Ortaya çıkan karbondioksit, kok karbonu ile temas ettiğinde (ters) Boudouard reaksiyonuna girer.
İstenmeyen olay
Boudouard reaksiyonu bazı proseslerde bilinçli olarak kullanılırken bazı proseslerde ise istenmemektedir. Gaz soğutmalı, grafit moderatörlü İngiliz nükleer reaktörlerinde (Magnox ve AGR), CO2 soğutucusu ile grafit moderatör arasındaki reaksiyondan kaçınılması veya en azından minimumda tutulması gerekiyordu. Daha düşük sıcaklıklarda reaksiyonun dengesi karbon lehine değiştiği için bu durum Magnox reaktöründe daha düşük bir çalışma sıcaklığına evrilerek çözüldü. Ancak bu da elde edilebilir termal verimliliği azalttı. Magnox'tan öğrenilen dersleri geliştirmesi beklenen AGR'de, daha yüksek bir soğutma sıvısı çıkış sıcaklığı açık bir tasarım hedefiydi (O zamanlar İngiltere kömür enerjisine bağımlı olduğundan amaç, kömürle çalışan tesislerle aynı buhar sıcaklığına ulaşmaktı) ve dolayısıyla Şablon:Dönüştürme daha düşük kazan çıkış sıcaklığında soğutucunun yeniden girişi akışı grafiti soğutmak için kullanılır ve grafit çekirdek sıcaklıklarının bir Magnox reaktöründe görülenlerden çok fazla değişmemesini sağlar.
Kaynaklar
Dış bağlantılar
- ↑ Şablon:Web kaynağı
- ↑ Şablon:Web kaynağı
- ↑ List of standard Gibbs free energies of formation
- ↑ Şablon:URL referansındaki değerlerin regresyonuna dayanmaktadır. Bu denklem, RT2 çarpı türevi ΔH için doğru bir formül vermese de oldukça doğru değerler vermektedir.
- ↑ ASM Committee on Furnace Atmospheres, Furnace atmospheres and carbon control, Metals Park, OH [1964].
- ↑ Şablon:Kitap kaynağı
- ↑ 7,0 7,1 Şablon:Akademik dergi kaynağı
- ↑ 8,0 8,1 Şablon:Akademik dergi kaynağı
- ↑ 9,0 9,1 Şablon:Akademik dergi kaynağı
- ↑ 10,0 10,1 Şablon:Akademik dergi kaynağı